炭酸ナトリウムの塩酸での中和滴定に関する問題では次のような問題がでてきます。
 [問題]
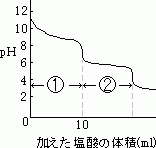
[問題]炭酸ナトリウム水溶液20mlを0.10mol/lの塩酸で中和滴定したところ、右の図のような滴定曲線が得られた。 (1)①,②でおこる中和反応をそれぞれ化学反応式で示せ。 (2)はじめの炭酸ナトリウム水溶液のモル濃度を求めよ。 (3)第2中和点に達するまでに0.10mol/lの塩酸は何ml必要か。 |
さて、ここで、実際に化学反応式を見てみましょう。グラフで、①にあたる部分の反応は
Na2CO3 + HCl → NaCl + NaHCO3 ・・・①
となります。これが(1)の①のときの化学反応式です。Na2CO3 + 2HCl → 2NaCl + H2CO3といきたいところなのですが、いきなり、ならずに、一度、NaHCO3になってから、次の反応がおきて、最終的には塩化ナトリウム(NaCl)と炭酸(H2CO3)になるのです。これは決まりごとですから今の段階では覚えておく必要があるかと思います。①の反応が起こると次に②の反応も起こるのですが、(2)をやるために、とりあえずは、ここで②の反応の話はとめておきます。
これをみてどう思うでしょうか。これは中和滴定なのですから、もちろん中和反応です。Na2CO3は反応式の右辺を見ると、H+を受け取ってますから、塩基です。HClはいうまでもなく酸です。ですから、中和反応なんです。では今まで、やってきた中和反応とみてどうでしょうか。今までやってきた中和反応はたとえば
NaOH + HCl → NaCl + H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
といったものではなかったでしょうか。このぐらいなら理解ってるよていう方も多いのではないでしょうか。でも①の式はよくわからないなぁといった方も少なからずいるはずです。ではなぜわからないのでしょうか。上の2つの式と①の式の大きな違いは塩基にOH-が含まれていないということなのです。OH-が含まれていれば、化学式見ただけで、価数がわかります。NaOHならOH-が一個なので1価、Ca(OH)2ならOH-が2個なので2価ということになります。じゃぁNa2CO3はいったい何価なのかと、思うはずです。だって、OH-がないから何価かわからないじゃん!でも原点に戻ってください。塩基と酸の定義はどのようなものだったでしょうか。
| 定義 | 酸 | 塩基 |
| アレニウス | 電離してH+(またはH3O+)を生じる物質 | 電離してOH-を生じる物質 |
| プレンステッド | H+を与える物質 | H+を受け取る物質 |
 よって、グラフより、HClが、10mlのとき、中和したということがわかります。ここで、Na2CO3のモル濃度をχmol/lとします。
よって、グラフより、HClが、10mlのとき、中和したということがわかります。ここで、Na2CO3のモル濃度をχmol/lとします。
| Na2CO3 | HCl | |
| 体積 | 20ml | 10ml |
| モル濃度(mol/l) | χ mol/l | 0.10 mol/l |
| 酸・塩基の価数 | 1価 | 1価 |
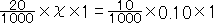 となります。これを計算して、χ= 0.050となります。したがって、Na2CO3のモル濃度は0.050mol/lとなります。ここでは、問題文に0.10mol/lや、20mlなど、有効数字2桁で書かれていることから、答えも有効数字2桁で表します。
となります。これを計算して、χ= 0.050となります。したがって、Na2CO3のモル濃度は0.050mol/lとなります。ここでは、問題文に0.10mol/lや、20mlなど、有効数字2桁で書かれていることから、答えも有効数字2桁で表します。では(3)の問題にいきましょう。まず、①の部分で起こる反応は、
Na2CO3 + HCl → NaCl + NaHCO3 ・・・①
です。次に、②で起こる反応は
NaHCO3 + HCl → NaCl + H2CO3・・・②
となります。①で発生したNaHCO3のすべてが②で反応するのです。ですから、②で反応したNaHCO3のmol数は、①で発生したNaHCO3のmol数と等しいわけです。
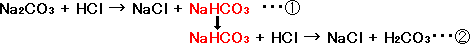
ですから、②のときに使ったHClは、①のときに使ったのと同じ量なんです。グラフより、①の時に使ったHClは10mlです。したがって、②の時に使ったHClも10mlです。ですから、第2中和点までに使ったHClは10+10=20、つまり、20mlなのです。
